巨噬細胞存在于機體各組織器官中,具有典型的功能表型異質性。巨噬細胞除了參與免疫防禦與調控之外,還在組織穩态構建、生長發育、體溫調節等多種生命活動中扮演關鍵角色。巨噬細胞是信号感受器(Sensor/Controller)與功能效應器(Plants),在響應外界複雜信号時,巨噬細胞可啟動特定的分子級聯反應,實現表型與功能的切換,以适應組織、器官功能運行的需求。因此,巨噬細胞在基因表達譜、分化途徑及功能性極化等多層面體現其複雜的異質性。依據巨噬細胞在體外培養中的激活類型而定義的M1、M2已不能準确描述組織中駐留巨噬細胞群的功能特性,涉及其中的複雜調控機制亦有待深入闡釋。根據對微環境的響應方式進行界定,M2型巨噬細胞又可細分為M2a、M2b、M2c與 M2d。M2c型巨噬細胞的主要功能特征為介導血管新生、組織重建與穩态維持,其中的分子機制研究尚處于初期階段。
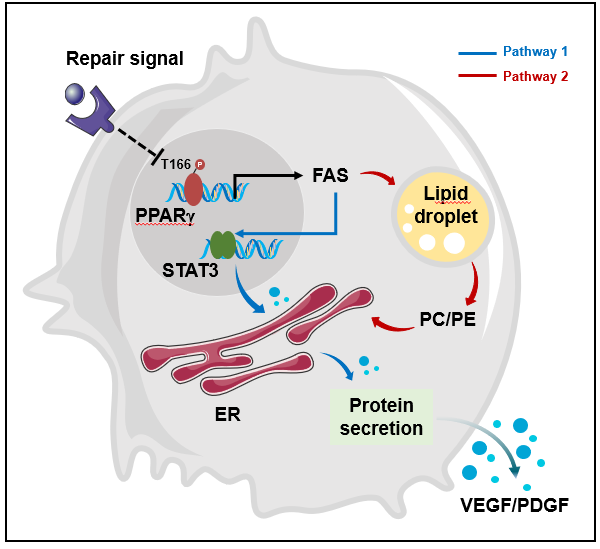
為探讨M2c巨噬細胞在功能調控中的分子基礎,本項目研究人員首先利用多種組織損傷中巨噬細胞的單細胞RNA測序(scRNA-seq)數據構建了M2c巨噬細胞Atlas,結果顯示:M2c巨噬細胞中脂肪酸合成(FAS)活性持續增強,且主要與組織修複功能密切相關,據此初步建立了脂質生物合成與巨噬細胞極化為M2c表型之間的關聯性;其後,研究者構建皮膚全層切除、急性肝髒損傷和肌肉損傷等多種動物模型,并結合細胞與分子免疫學實驗、多組學聯合分析,對M2c巨噬細胞極化過程中的關鍵代謝調控節點進行了深入細緻的剖析,建立了以PPARg T166磷酸化為核心節點的巨噬細胞FAS功能調控網絡。具體為:在受損組織中,修複信号導緻巨噬細胞PPARγ T166磷酸化水平降低,從而促進PPARγ與FAS相關基因調節區域結合,最終誘導胞内脂質的生成與積累。細胞中新生脂質可誘導STAT3介導的血小闆衍生生長因子(PDGF)、轉化生長因子-b(TGF- b)和血管内皮生長因子(VEGF)等産生,以促進血管新生和再上皮化過程。另一方面,新生脂質可合成磷脂以支持内質網擴張,進而為修複蛋白分泌提供胞内支持。在此過程中,運用遺傳或小分子抑制PPARg T166磷酸化的手段,可顯著促進巨噬細胞的修複功能,進而影響組織再生進程。綜上,該研究确定了以PPARg T166磷酸化修飾為核心的代謝重塑是修複型巨噬細胞功能發揮的關鍵途徑。
該項目通過研究M2c巨噬細胞在組織修複中的關鍵生物學功能,提出了PPARg T166翻譯後修飾介導的脂質合成通路在M2c表型極化中的調控新機制,同時獲得具有潛在臨床轉化價值的重要調控因子信息。該研究不僅提出巨噬細胞功能極化的新原理,而且為臨床組織修複提供了新思路。
伟徳国际官网登录入口、醫藥生物技術全國重點實驗室沈萍萍教授團隊在M2c修複型巨噬細胞功能極化的調控機制方面取得重要研究進展。相關成果以“Lipid synthesis, triggered by PPARg T166 dephosphorylation, sustains reparative function of macrophages during tissue repair” 為題于2024年8月23日在Nature Communications 上在線發表。原文下載鍊接:https://doi.org/10.1038/s41467-024-51736-5。伟徳国际官网登录入口博士研究生左詩曼和王于昕為論文的共同第一作者,沈萍萍教授為論文通訊作者。
該研究工作得到江蘇省前沿引領技術基礎研究重大項目、廣東省基礎與應用基礎研究基金、科技部國家重點研發計劃重點專項“蛋白質機器與生命過程調控”的資助與支持。