
氧化還原修飾是天然産物生物合成中的重要化學過程。這一過程可大大提高天然産物結構的複雜性,提升天然産物的生物活性、增加水溶性等作用。氧化還原修飾是由一系列氧化還原酶所介導的,比如:細胞色素P450、α-酮戊二酸依賴的氧化酶,NAD(P)H/NAD(P)+以及黃素等依賴的氧化還原酶等。這些氧化/還原酶介導的天然産物的化學修飾甚至骨架的重排,大大豐富了天然産物結構的多樣性。因此,闡明天然産物合成過程中氧化還原酶所扮演的角色,對于其後續的成藥性研究以及發展新型的生物催化工具具有重要的意義。
近期,伟徳国际官网登录入口戈惠明和譚仁祥課題組闡釋了Alchivemycin A(AVM,1)生物過程中的氧化還原次級代謝網絡,包括AVM關鍵藥效團的形成及自抗性研究。相關工作“Redox Modifications in the Biosynthesis of Alchivemycin A Enable the Formation of Its Key Pharmacophore”發表在J. Am. Chem. Soc.上。

AVM是日本科學家從植物内生放線菌Streptomyces sp. TP-A0867中分離得到的複雜多環聚酮化合物,具有強勁的抗菌活性。AVM具有罕見的2H-四氫-4,6-二氧代-1,2-惡嗪(TDO)環系統,以及包括兩個環氧環在内的衆多氧化後修飾。然而,至今AVM生物合成的氧化還原後修飾過程特别是獨特惡嗪環的形成過程以及其抗菌機制,未有報道。
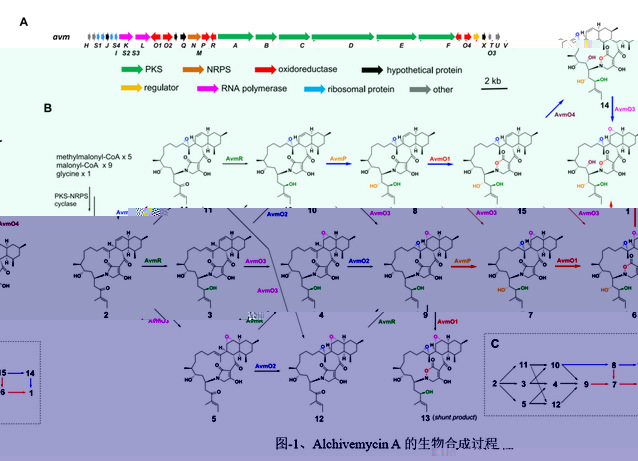
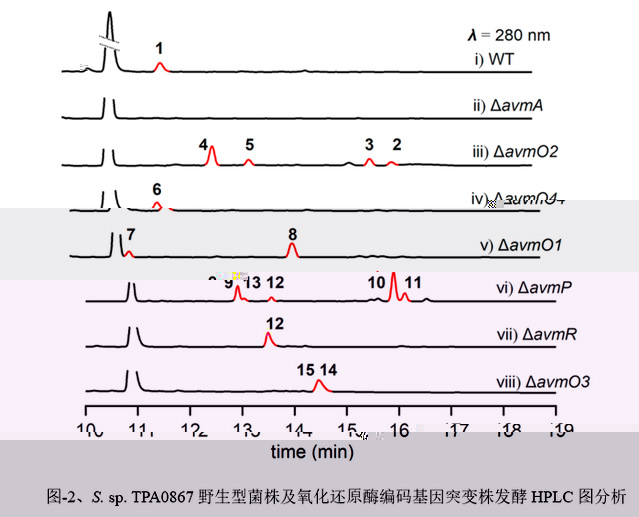
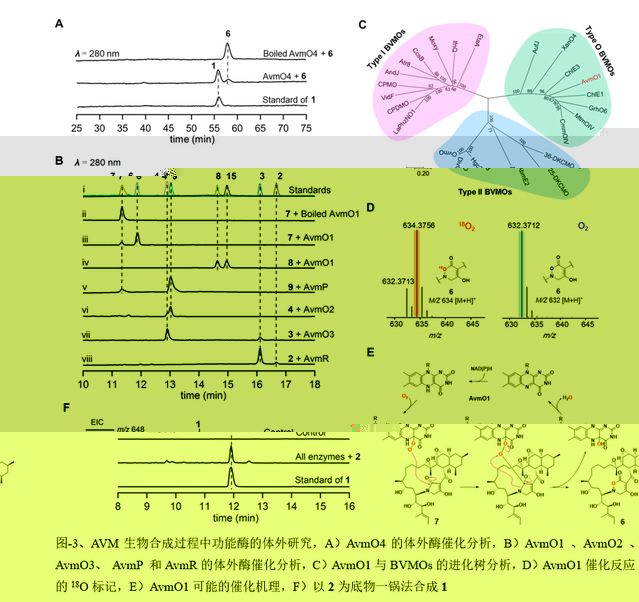
在這項研究中,作者闡明了一種涉及六種氧化還原酶催化AVM形成的氧化還原代謝網絡。作者通過體内基因敲除,體外生化分析和一鍋酶法合成來表征了這種複雜的氧化還原網絡。突變株中得到的前體化合物2可以相對無序的經FAD依賴的單加氧酶(AvmO1,AvmO2,AvmO3),F420依賴的氧化還原酶(AvmR),α-KG/Fe2+依賴的雙加氧酶(AvmO4)以及P450(AvmP)作用,通過12條不同的路徑網絡化生成AVM(圖-1,2,3)。首先,2可以經過AvmR,AvmO2,AvmO3作用分别将C25位的羰基還原為羟基,以及形成C14-C15位和C11-C12位的環氧環,這3個酶的催化并沒有先後之分,但最終都彙聚生成化合物9。中間體9随後依次經AvmP(C24位羟基化)、AvmO1(TDO環形成)和AvmO4(C22位羟基化)作用形成終産物AVM(圖-1,紅色箭頭,路徑a)。另外,化合物10也可以經AvmP、AvmO1、AvmO4和AvmO3催化得到AVM(圖-1,藍色箭頭,路徑b),其中路徑b中的8,10,15又可以通過AvmO3彙聚到路徑a中,最終以一種氧化還原網絡的形式生成AVM(圖-1)。最後,作者以化合物2為底物,在體外用6個酶重構了AVM的生成(圖-3F)。
更重要的是,作者發現并闡明了FAD依賴的單加氧酶AvmO1催化酰胺鍵上C-N間的插氧形成AVM中的TDO環,這與Bayer-Villiger單加氧酶(BVMOs)催化的反應十分相似,并且氧标記實驗也證實AvmO1催化的反應過程可能與Bayer-Villiger氧化一緻(圖-3)。但之前報道的BVMO未見有C-N間插氧的報道,這可能代表了黃素氧化酶一種前所未有的催化功能。
在随後的活性測試中作者還發現,TDO環對于AVM的抗菌活性至關重要,在将編碼負責RNA聚合酶β亞基合成的基因avmK導入AVM敏感菌株Streptomyces sp. 120454後發現,AVM對其生長不再産生影響(圖-4)。這表明AVM可以靶向性與RNA聚合酶的β亞基相互作用産生抗菌活性,而微生物自身通過靶标修飾賦予AVM自抗性。這反映了一種微生物在應對環境變化與生存競争過程中有意思的進化過程,首先通過自身酶修飾産生含TDO環的抑菌化合物,抑制其他微生物生長以保證自身獲得更充足的生存空間,然後将自身的RNA聚合酶β亞基(即抑菌分子的作用靶點)突變産生自抗性而不受影響。
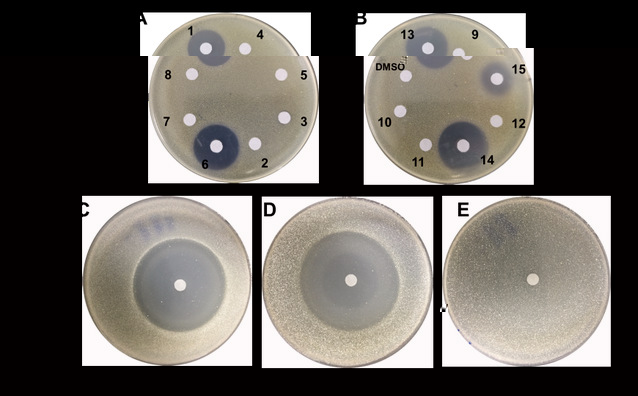
圖-4、AVM及類似物的活性及自抗性研究,A,B)AVM及類似物對Micrococcus luteus的作用效果,C,D,E)AVM對S. sp. 120454野生型及導入不同基因後菌株的作用效果
綜上,本論文通過一系列體内,體外生化實驗闡明了AVM的生物合成過程,其中包括一個前所未有的FAD依賴的單加氧酶催化的C-N間的插氧,且其介導形成的TDO環是AVM發揮抗菌作用的關鍵藥效基團。同時定位到了AVM抗菌的作用靶點RNA聚合酶β亞基及其自抗性基因avmK。本文的發現擴展了黃素氧化酶的功能範圍,并為基于AVM的抗菌化合物和生物催化劑開發提供了更多見解。
伟徳国际官网登录入口博士研究生朱宏傑為文章第一作者,戈惠明教授和譚仁祥教授為文章共同通訊作者,伟徳国际官网登录入口醫藥生物技術國家重點實驗室為第一單位。
該項研究工作得到國家傑出青年基金、國家重點研發計劃等項目的資助。
文章鍊接:https://pubs.acs.org/doi/10.1021/jacs.1c00516