2006年,美國科學家Andrew Fire和Craig Mello獲得了諾貝爾生理學或醫學獎,表彰他們的RNA幹擾(RNA interference, RNAi)研究工作,同時也揭開了RNA幹擾機制的嶄新篇章。如今,RNA幹擾技術越來越多地被用于調控人類基因的表達。在動植物中存在一類長度約為22 nt的非編碼單鍊RNA分子microRNA(miRNA),它們能通過RNAi參與轉錄後基因的表達調控。早在2011年,伟徳国际官网登录入口張辰宇團隊首次發現了食物性來源miRNA可以被哺乳動物吸收,并經過外泌體的運輸,調控動物靶基因的表達。這種異源miRNA進入哺乳動物細胞并參與基因調控的現象被稱為“基因跨界調控”,颠覆了此前外源核酸不能被哺乳動物的消化道完整吸收,并在體内有生物學功能的經典生物化學概念,也從一種新的維度對俗語“人如其食(You are what you eat)”進行了科學解釋:一定程度上,食物可以影響攝食者。
在線蟲系統性RNAi的研究中,發現跨膜蛋白SID-1(systemic RNA interference defective protein 1)在介導外源雙鍊RNA(double-stranded RNA, dsRNA)的吸收方面扮演着關鍵的角色,被認為是重要的核酸轉運通道。在哺乳動物細胞中,存在與SID-1有相似核酸轉運功能的兩個同源跨膜蛋白,分别是SIDT1和SIDT2 (SID1 transmembrane family member 1/2)。SIDT2參與了細胞内DNA/RNA自噬過程,并将溶酶體内化的核酸轉運至細胞質,引發先天免疫反應,SIDT1更是直接介導食物性來源miRNA的吸收。研究發現,胃部是吸收食物小RNA的主要部位,在哺乳動物的胃粘膜頂細胞(pit cells)上表達的SIDT1是吸收外源小RNA的關鍵蛋白質。值得注意的是,這一過程在極低pH的胃酸環境下得到顯著促進,酸刺激極大程度地促進了miRNA的吸收。這一颠覆性的發現為小RNA的“跨界調控”提供了進一步的證據,為基于小RNA的治療提供了新策略,也為基于RNA的藥物開發提供了潛在方向。雖然越來越多的科研團隊相關的研究都支持哺乳動物SID-1跨膜家族蛋白SIDT1和SIDT2介導核酸轉運,但是SID-1跨膜家族蛋白SIDT1和SIDT2介導異源小RNA吸收的分子機制仍然不夠清楚,特别是關于低pH條件下促進小RNA吸收過程的機制仍然未知。
2023年11月6日,伟徳国际官网登录入口醫藥生物技術全國重點實驗室籍曉雲教授團隊和張辰宇教授團隊聯合中國科學院生物物理所孫飛研究員和朱赟研究員,在Cell Research雜志上在線發表了題為Cryo-EM structures of human SID-1 transmembrane family proteins and implications for their low-pH-dependent RNA transport activity的研究論文。該研究利用冷凍電鏡單顆粒技術首次同時解析人源SIDT1和SIDT2蛋白質的同源二聚體三維結構。該團隊首次發現SIDT1和SIDT2以pH依賴的方式結合miRNA,并誘發SIDT1和SIDT2的進一步寡聚化。該研究從分子層面揭示了酸性環境促進小RNA吸收的分子機理,揭示了SIDT1及SIDT2介導核酸轉運的潛在分子機制,對深入理解SIDT1和SIDT2在酸性微環境中的功能調控以及RNA 遞送系統的開發具有潛在意義。

研究團隊首先攻克了膜蛋白樣品表達純化困難和在冷凍樣品制備過程中存在嚴重取向優勢等難題,成功利用冷凍電鏡單顆粒技術同時獲得了人源SIDT1和SIDT2三維結構。SIDT1和SIDT2都含有一個胞外結構域(extracellular domain, ECD)、一個由11次跨膜螺旋組成的跨膜結構域(transmembrane domain, TMD),以及一個柔性的胞内結構域(intracellular domain, ICD)。通過結構分析,研究人員發現SIDT1和SIDT2的結構高度相似,這也提示它們可能具有相似的生物學功能。同時研究人員還發現了進化保守的位點,如二硫鍵和糖基化位點,它們對 SIDT1 和 SIDT2 在酸性條件下的穩定性和結構完整性起着至關重要的作用。此外,研究人員檢測了 SIDT1 和 SIDT2 在體外和活細胞中的聚合狀态,結果表明這兩種蛋白質都以二聚體或寡聚體的形式存在,并且TMD 對于維持二聚體至關重要。這些發現為理解 SIDT1 和 SIDT2 在體内的功能提供了重要信息。
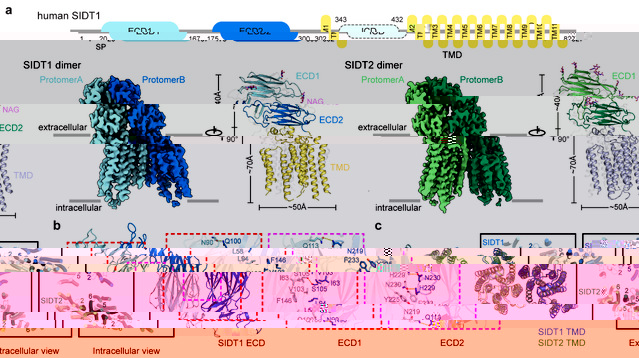
SIDT1和SIDT2同源二聚體的冷凍電鏡結構
為了揭示SIDT1 和 SIDT2 介導小RNA 轉運的分子機制,研究人員進一步探究了它們的 ECD 與小 RNA 的結合情況。實驗結果顯示,SIDT1 和 SIDT2 的 ECDs 能以 pH 依賴性方式有效地與小 RNA 結合。在酸性條件下,ECDs 與小 RNA 的結合親和力增加,這種結合進一步引發了 ECDs 的寡聚化。這一發現推翻了前期報道的SIDT1ECD和SIDT2ECD隻能結合較長的雙鍊RNA(>100 bp)的觀點。同時,研究人員還發現ECD蛋白在酸性條件下與核酸的結合不受核酸種類、單雙鍊的特異性影響,并且這種結合存在pH依賴性。最後,通過分析型超速離心和凝膠過濾層析分析,研究團隊還發現在酸性條件下,SIDT1和SIDT2與核酸結合能夠誘導蛋白質的寡聚化,表明它們具有形成核酸孔道的潛力。該項研究揭示了低 pH 環境促進 SIDT1 和 SIDT2 吸收外源小 RNA的關鍵作用,加強了在低pH條件下促進小RNA的跨膜吸收的分子機制理論基礎。
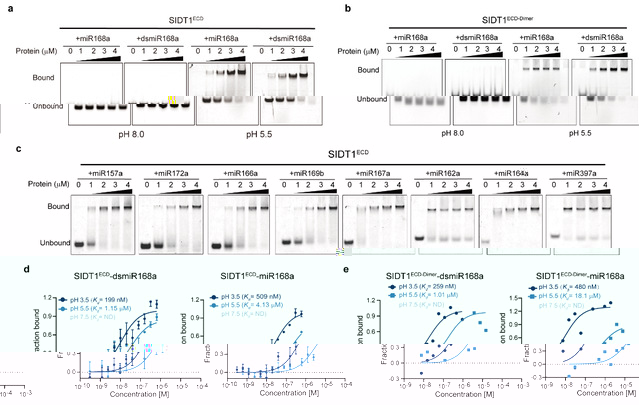
SIDT1以pH依賴的方式結合miRNAs
綜上所述,本研究解析了哺乳動物細胞跨膜家族蛋白SIDT1和SIDT2的冷凍電鏡結構,并首次提出了SIDT1 和 SIDT2 與 RNA 的 pH 依賴性結合和寡聚化的分子特征。因此,該項研究為SID-1跨膜家族蛋白在核酸轉運方面提供了分子基礎,同時也為“基因跨界調控”現象提供了直接的理論分子依據。伟徳国际官网登录入口博士研究生鄭樂、楊婷婷,伟徳国际官网登录入口博士後郭航天,中國科學院生物物理所博士研究生岐晨,以及上海科技大學免疫化學研究所博士研究生盧宇馳為該論文的共同第一作者。伟徳国际官网登录入口籍曉雲教授、張辰宇教授,中國科學院生物物理所孫飛研究員、朱赟研究員,以及伟徳国际官网登录入口博士後郭航天為該論文的共同通訊作者。該研究工作得到了國家重點研發計劃和國家自然科學基金等項目的資助,在此一并緻謝!
原文鍊接:https://www.nature.com/articles/s41422-023-00893-1