現代社會,緊張而充滿壓力的工作生活往往引發強迫症(obsessive-compulsive disorder)和焦慮症(anxiety disorders)。60歲以下成年人中焦慮症的終生患病率約為30-35%,而一般人群中完全強迫症的終生患病率約為2-3%、強迫症狀的終生患病率則高達25%以上。二者均被WHO列為全球非緻命健康損失的主要貢獻者。強迫症以反複闖入的、不可控的強迫思維(obsessions)和儀式化的、重複的強迫行為(compulsions)為主要症狀,而強迫行為的發生往往是為了摒棄強迫思維和緩解由強迫思維引起的焦慮,提示強迫症與焦慮症密切相關。事實上,流行病學調查表明,焦慮症是強迫症最常見的共病。然而,二者共病的神經環路基礎和臨床有效治療靶點至今不明。
近日,我校伟徳国际官网登录入口、醫藥生物技術國家重點實驗室和腦科學研究院朱景甯教授團隊在強迫症和焦慮症共病的神經機制和潛在改善靶點的研究中取得重要進展。該課題組在其近年來對下丘腦調控基底神經節環路功能系列研究(Zhuang et al., J Clin Invest, 2018; Ji et al., Mol Psychiatry, 2019)的基礎上,新構建了HDC-Cre大鼠(HDC為體内催化組胺合成的關鍵酶),并發現選擇性激活中樞組胺能神經系統的唯一起源下丘腦結節乳頭體核(tuberomammillary nucleus, TMN)到伏隔核(nucleus accumbens, NAc)核心部的組胺能直接神經投射能夠通過作用于突觸前H3受體,改善由急性束縛應激誘導的焦慮和強迫症樣行為(圖1)。NAc核心部中的組胺H3受體作為突觸前異身受體發揮選擇性抑制谷氨酸能而非GABA能突觸傳遞的作用。盡管組胺H3受體在來自内側前額葉皮層的前邊緣皮層(prelimbic prefrontal cortex, PrL)、基底外側杏仁核(basolateral amygdala, BLA)和腹側海馬(ventral hippocampus, vHipp)的谷氨酸能神經投射的軸突末梢均有表達,但光遺傳學和化學遺傳學選擇性操控表明,隻有PrL-NAc通路才是NAc核心部谷氨酸能神經傳入中唯一同時介導焦慮和強迫症樣行為的神經環路。抑制PrL-NAc谷氨酸能神經環路可預防急性束縛應激誘發的焦慮伴強迫症樣行為,而組胺或H3受體選擇性激動劑RAMH則可顯著改善光激活PrL-NAc谷氨酸能神經環路誘導的焦慮伴強迫症樣表型(圖2)。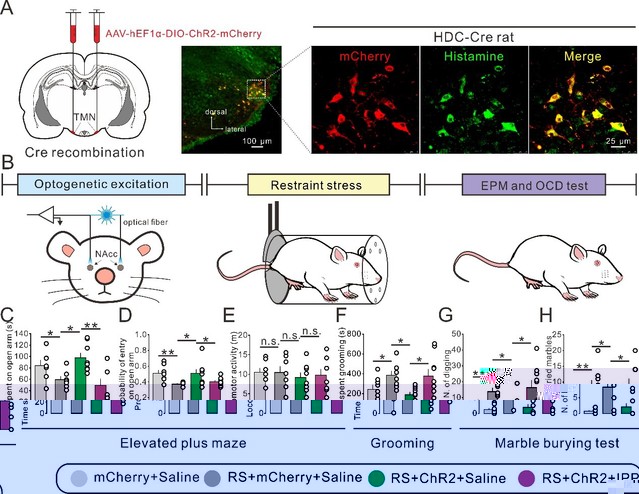
圖1. 光遺傳學選擇性激活TMN-NAc組胺能神經投射改善由束縛應激誘導的大鼠焦慮樣和強迫症樣行為
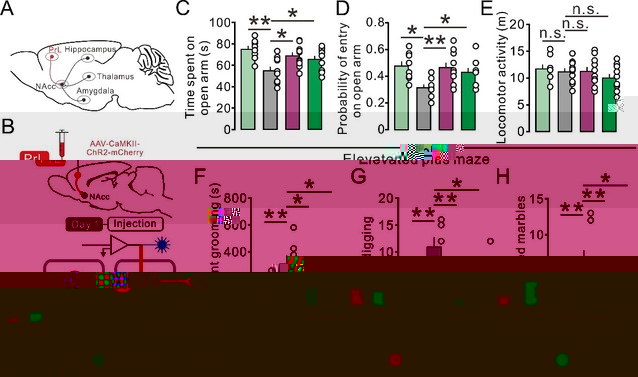
圖2. 激活組胺H3受體改善由光遺傳學選擇性激活PrL-NAc谷氨酸能神經環路誘導的焦慮伴發強迫症樣行為
該研究成果揭示了一條介導強迫症和焦慮症共病的PrL-NAc谷氨酸能神經環路,而該環路受到組胺H3突觸前異身受體的調控。這一成果将為臨床認識強迫症和焦慮症共病發生發展的病理生理機制、深部腦刺激NAc治療難治性強迫症和焦慮症的神經機制以及靶向突觸前H3受體潛在治療策略的研發提供了全新的視角。
該項研究成果以“Targeting presynaptic H3 heteroreceptor in nucleus accumbens to improve anxiety and obsessive-compulsive-like behaviors”為題于2020年11月30日在PNAS上在線發表(https://www.pnas.org/content/early/2020/11/25/2008456117)。伟徳国际官网登录入口副研究員張潇洋、博士後彭詩宇(現為上海交大醫學院附屬精衛中心助理研究員)、博士研究生沈麗萍和副研究員莊乾興(現為南通大學醫學院生理學系教授)為論文的共同第一作者,副研究員李斌(現為南京醫科大學第一附屬醫院副研究員)為共同通訊作者,本科生史明潤和馬天宇參與了本項工作的研究。該工作受到國家自然科學基金和江蘇省自然科學基金的資助。