近年來,随着多種外泌體蛋白的功能被揭示,它們在腫瘤診斷和治療中的作用也越來越受到關注,尤其對于乳腺癌這種具有高度異質性的惡性腫瘤來說,外泌體蛋白在區分不同乳腺癌亞型和預測腫瘤進展中具有重要的作用和應用前景。但是,外泌體的粒徑隻有30-150納米大小,而且體液環境複雜,傳統的蛋白檢測方法,如Western Blotting,ELISA等因靈敏度不夠,步驟繁瑣等無法推向臨床應用。
近日,伟徳国际官网登录入口伟徳国际官网登录入口,醫藥生物技術全國重點實驗室項陽教授課題組報道了一種基于不對稱撕裂DNAzyme的乳腺癌外泌體蛋白雙模式檢測平台,将G-四鍊體結構的單鍊DNA酶分成不對稱的兩段,嫁接到與部分适體互補的核苷酸序列末端。适體的存在促進了分裂的DNA酶接近形成,且能産生比色和電化學信号輸出的活性G-四鍊體結構,可用于乳腺癌外泌體蛋白的精準分析。
在本研究中,如圖1所示。首先,乳腺癌來源的外泌體被修飾CD63适體的磁珠捕獲。随後,将針對PD-L1或MUC1蛋白的适體加入體系中。适體能夠通過特異性識别并結合外泌體上的PD-L1或MUC1蛋白,未被結合的适體通過磁分離收集到離心管中并分别加入含有三個-GGG-重複片段和單個-GGG-重複片段且與适體一半配對的核苷酸序列。兩段核苷酸在不存在适體的情況下保持分離,但在存在适體的情況下可以接近折疊成G4結構,不僅可以催化2,2'-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸(ABTS)的氧化,産生比色信号,還可以組裝到電極上,催化對苯二酚(HQ)氧化,産生電化學信号,實現外泌體表面蛋白的雙模式檢測。與其他傳感器相比,該傳感器優勢明顯:(1)雙模式傳感器可以彼此對照,展示各自的優勢,實現對外泌體表面蛋白的精準檢測。(2)操作簡單,背景信号低,有利于開發便攜式傳感器。(3)不需要使用商品化氧化酶,也不需要标記,節約了成本。(4)通過改變适體和對應的撕裂DNAzyme探針,可以用于多種外泌體膜蛋白分析。
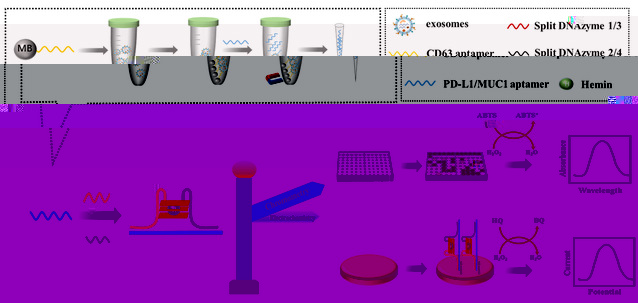
圖1.基于不對稱撕裂DNAzyme的乳腺癌外泌體蛋白雙模式檢測平台示意圖
經過實驗驗證,如圖2所示。該傳感器能夠有效分辨乳腺癌細胞MCF-7和MDA-MB-231來源外泌體中MUC1或PD-L1含量的變化。同時,經過臨床血清标本驗證,根據MUC1或PD-L1含量的變化,它可以很好的區分不同類型乳腺癌患者和健康對照,具有較大的臨床應用潛力。
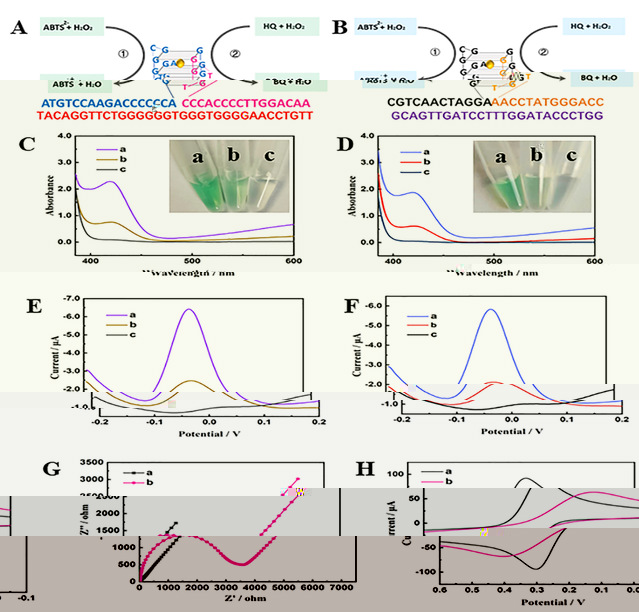
圖2. 乳腺癌外泌體蛋白雙模式檢測模式及可行性分析
南京大學伟徳国际官网登录入口博士研究生程文婷為論文的第一作者,南京大學項陽教授和南京醫科大學第一附屬醫院王忠雲主任為論文的共同通訊作者。以“Asymmetrically Split DNAzyme-Based Colorimetric and Electrochemical dual-modal biosensor for Detection of Breast Cancer Exosomal Surface Proteins”為題發表在國際著名期刊Biosens Bioelectron上(doi: 10.1016/j.bios.2023.115552,中科院1區,IF:12.6)。該研究工作受到國家自然科學基金、國家重點實驗室開放課題和伟徳国际官网登录入口博士研究生創新計劃項目的資助。

參考文獻:Asymmetrically Split DNAzyme-Based Colorimetric and Electrochemical dual-modal biosensor for Detection of Breast Cancer Exosomal Surface Proteins. Biosens Bioelectron, 238 (2023) 115552.