細胞膜上的鉀離子通道具有内向整流效應,即鉀離子經過通道向細胞内輸送的效率高于向外的效率,這一效應被認為來源于細胞内陽離子(例如鎂離子Mg2+)和多胺的阻擋。受這種生命現象的啟發,我校李根喜教授課題組近期與沙特阿拉伯納吉蘭大學Farid A. Harraz教授、南京師範大學高濤副教授合作,通過在人工納米通道内修飾多肽分子,仿生構建了一種用于疾病标志物檢測的生物傳感平台,并且利用多肽等電點的變化實現了離子電流整流效應的可靠調控,從而實現了特定種類酶的檢測。
不同種類的多肽具有特征的等電點,其電學性質依賴于生物體系的酸堿(pH)環境,從而體現出不同的生物功能。同時,由于多肽具有易修飾、組裝多樣化和生物友好性等特點,因此可以通過熱力學和動力學因素來調控多肽的組裝,并将其嵌入在納米空間内來實現多種生物功能。如圖1所示,研究團隊将功能性多肽修飾在人工納米通道中,在生理pH條件下,不同等電點的多肽序列使得通道表面帶有正負性相反的電荷。帶正電荷的納米通道具有陰離子選擇性,表現出陰離子通道的整流效應。相反,當修飾帶負電荷的多肽時,納米通道表現出離子整流方向的反轉現象,并且可以反映在電流-電壓(I-V)測量曲線上。由于在特定酶的作用下,多肽的等電點将發生改變,因此,如果在納米通道中修飾含有特定酶作用位點的多肽,則可以通過納米通道電學特性的變化實現特定酶的檢測。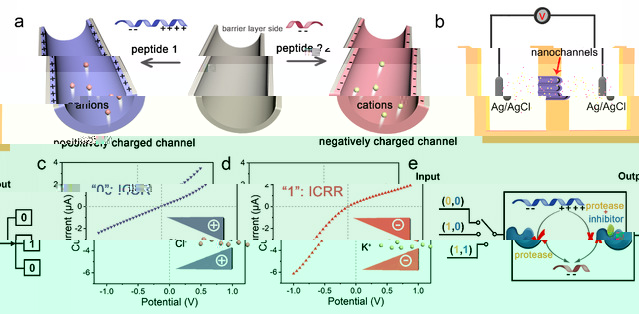
圖1 利用多肽功能化納米通道的離子電流整流反轉構建電化學生物傳感的原理
李根喜教授課題組長期從事生物分子工程及疾病診斷應用方面的研究工作,因此研究團隊以腫瘤标志物基質金屬蛋白酶-2(MMP-2)的檢測為例,将含有MMP-2酶切位點的多肽作為底物肽修飾在納米通道的表面(圖2),底物肽的等電點大于生理pH,該底物肽功能化修飾的納米通道表面帶正電荷,但是在MMP-2的催化下,底物肽在肽序列PLGVR的Gly和Val之間被切割,導緻呈正電荷的氨基酸脫落,留在通道表面的多肽的等電點随之改變。因此,在生理條件下,多肽酶切将納米通道表面電荷極性從正電調控為負電,并且相應地可以直觀地反映在I-V曲線上。
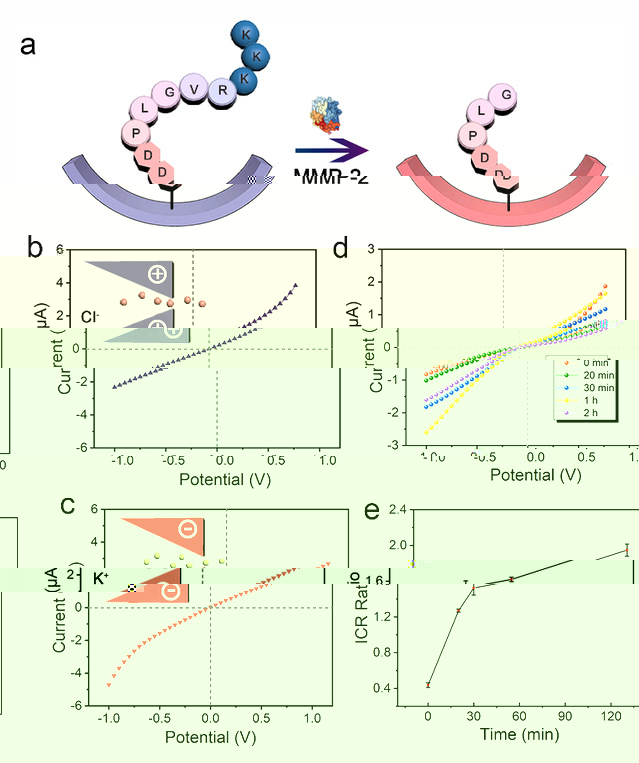
圖2 多肽功能化納米通道用于腫瘤标志物的檢測
進一步研究表明,該傳感平台不僅能夠用于蛋白酶的可靠檢測,而且可以拓展應用到酶抑制劑的篩選。同時,該平台基于多肽等電點變化産生的離子整流反轉作為生物傳感器的輸出信号,因此更加準确、直觀。此外,由于多肽具有豐富的物化性質和生物功能,利用多肽組裝可以設計更多新穎的生物傳感界面,從而應用到更廣泛的與多肽相關的疾病标志物的分析檢測。
上述成果以“Peptide Assembled in Nano-Confined Space as Molecular Rectifier for the Availability of Ionic Current Modulation”為題發表于Nano Letters(DOI:https://doi.org/10.1021/acs.nanolett.1c04154),李根喜教授與南京師範大學高濤副教授、沙特阿拉伯納吉蘭大學Farid A. Harraz教授為共同通訊作者,伟徳国际官网登录入口博士研究生石榴為論文第一作者。該項工作得到了國家自然科學基金、中央高校基本科研基金、江蘇省自然科學基金以及國際合作項目沙特阿拉伯教育部研究與創新基金等基金的資助。