代謝重編程是腫瘤的顯著特征之一。即使在氧氣供應充足的情況下,腫瘤細胞依然選擇将線粒體氧化磷酸化(OXPHOS)轉變為有氧糖酵解,以促進細胞增殖,這種現象被稱為Warburg效應。越來越多的證據表明,癌基因的激活和抑癌基因的功能缺失突變均可促進代謝向有氧糖酵解轉換,提示代謝重編程可能是癌基因和抑癌基因博弈的結果之一。然而,迄今尚不清楚腫瘤中是否存在能阻止代謝重編程且罕見突變的抑癌因子。
細胞因子樣蛋白1(Cytokine-like 1, CYTL1)是一個小分子量的分泌蛋白,最初在骨髓和臍帶血來源的CD34+細胞中被發現。目前已發現分泌型CYTL1發揮多種生物學功能,如調節骨穩态、調控心髒纖維化和促血管生成等。但對于其在細胞内的功能,仍然知之甚少,伟徳国际官网登录入口徐強團隊進行了重點研究。
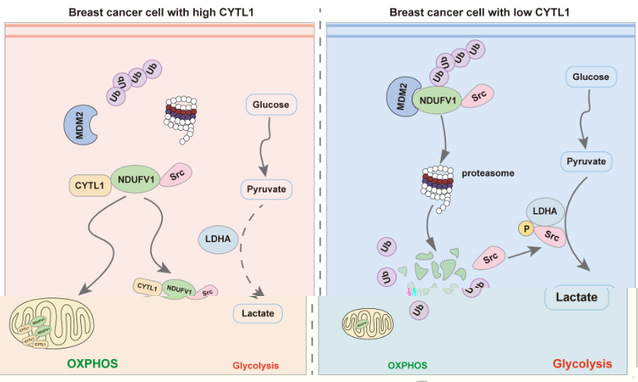
研究人員首先發現了乳腺癌患者組織中低表達的CYTL1水平與胞内型CYTL1的新功能,通過生物信息學分析、葡萄糖吸收、海馬檢測、乳酸檢測等手段,發現乳腺癌中CYTL1低表達是促進代謝向有氧糖酵解轉變所必需的。進一步證明,乳腺癌細胞中CYTL1的低表達不受DNA甲基化調控,而是細胞主動控制其分泌的結果,提示乳腺癌細胞中CYTL1的存在不利于腫瘤細胞的生存。分泌至胞外的CYTL1不再具備影響乳腺癌細胞的代謝重編程的能力,在胞内表達CYTL1則可顯著抑制乳腺癌細胞的有氧糖酵解及細胞增殖、遷移,相關結果在乳腺癌原位移植瘤模型中也得到了驗證。這些結果表明胞内型CYTL1作為重要的抑癌因子在調控乳腺癌代謝重編程中發揮重要作用。
其次,對胞内CYTL1調控代謝重編程的作用機制進行了進一步的探究。發現胞内型CYTL1可與MDM2競争性結合在NDUFV1的1-80結構域,從而幹擾NDUFV1的泛素化降解,穩定NDUFV1的水平,實現穩态的OXPHOS代謝。同時,NDUFV1可與Src相互作用抑制LDHA的活性,抑制有氧糖酵解。這一發現提示乳腺癌通過降低胞内CYTL1的水平使其代謝從OXPHOS重編程為糖酵解,從而有利于腫瘤細胞的生存和發展。需要指出的是,與p53等已知的抑癌基因不同,CYTL1迄今未見突變的報道。
因此,該研究揭示了CYTL1具有新型的抑癌因子特征,維持腫瘤代謝穩态的功能。調節細胞内CYTL1的表達及其對NDUFV1蛋白的穩定可能成為乳腺癌治療的新策略。
基于以上研究結果,2022年2月4日伟徳国际官网登录入口徐強團隊在Signal Transduction and Targeted Therapy (IF=18.187)上以全文形式發表題為“Intracellular CYTL1, a novel tumor suppressor, stabilizes NDUFV1 to inhibit metabolic reprogramming in breast cancer”的研究論文,提出胞内型CYTL1具有新型抑癌因子特征,其機理系通過穩定NDUFV1抑制乳腺癌代謝重編程。
伟徳国际官网登录入口薛文文博士和李馨博士是該論文的共同第一作者,伟徳国际官网登录入口徐強教授和沈燕副教授為共同通訊作者。該工作也得到了國家自然科學基金,江蘇省自然科學基金等項目的資助。
原文鍊接:Signal Transduct Target Ther. 2022 Feb 4;7(1):35. doi: 10.1038/s41392-021-00856-1.
參考文獻:
1. Warburg, O. On the origin of cancer cells. Science 123, 309-314, doi:10.1126/science.123.3191.309 (1956).
2. Kim, J. W. & Dang, C. V. Cancer's molecular sweet tooth and the Warburg effect. Cancer research 66, 8927-8930, doi:10.1158/0008-5472.CAN-06-1501 (2006).
3. Zhu, S. et al. Protein Cytl1: its role in chondrogenesis, cartilage homeostasis, and disease. Cellular and molecular life sciences : CMLS 76, 3515-3523, doi:10.1007/s00018-019-03137-x (2019).