新型冠狀病毒(SARS-CoV-2)是一類重要的病原體,由它引發的COVID-19大流行是一場前所未有的全球性健康危機,已導緻全球超過686萬人死亡。迄今為止,對冠狀病毒的基礎研究、藥物設計和疫苗研發仍有很多重要的科學問題沒有解決。自2021年11月起,奧密克戎(Omicron)變異毒株及其亞型逐漸成為主要流行毒株。Omicron變異毒株的刺突蛋白(Spike)不斷積累新的突變位點,使病毒具有更強的傳染性和免疫逃逸能力。因此,迫切需要開發針對所有SARS-CoV-2流行毒株的新型廣譜中和抗體,并深入研究廣譜抗體的中和機制。
近日,伟徳国际官网登录入口醫藥生物技術國家重點實驗室籍曉雲課題組聯合伟徳国际官网登录入口醫學院附屬鼓樓醫院陳雨欣團隊,利用冷凍電鏡單顆粒技術解析了Omicron變異毒株BA.1亞系的Spike蛋白與一種兔源單克隆抗體(RmAb)1H1複合物的高分辨率結構。研究團隊從結構生物學角度闡明1H1獨特的廣譜中和機制,為深入理解病毒與抗體相互作用的結構基礎和開發更多具有廣譜中和活性的治療性抗體提供新的思路。

研究團隊首先利用假病毒細胞感染實驗,确定了1H1(從接受DNA初次免疫-蛋白質增強免疫策略的免疫家兔中分離)能夠有效中和多種新冠假病毒,包括野生型(WT)、Delta和最近流行的Omicron亞系BA.1、BA.1.1、BA.2、BA.2.12.1、BA.2.75、BA.3以及BA.4/5毒株。這表明1H1具有巨大的潛在廣譜中和活性。ELISA實驗和BLI實驗也從生化水平證明1H1對這些毒株Spike蛋白的ECD和RBD均表現出很強的結合親和力。
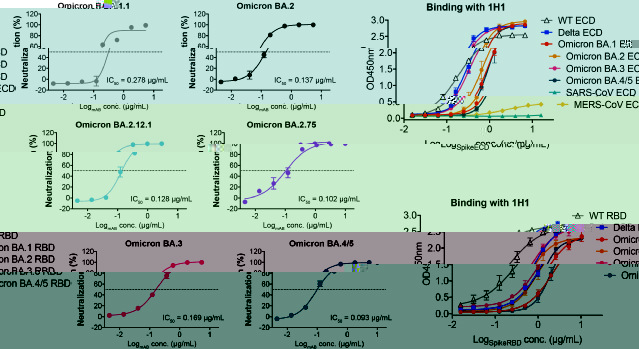
圖1. 兔源中和抗體1H1廣譜中和SARS-CoV-2 Omicron亞系
研究團隊使用冷凍電鏡技術獲得了BA.1 Spike-1H1 Fab複合物的兩種結合模式的高分辨率結構模型,分辨率分别為3.41 Å與3.70 Å。在這兩類複合物中,每個Spike蛋白均同時與3個1H1 Fab結合。在第I類複合物中,BA.1 Spike蛋白存在一種三個“半開放”構象RBD的狀态,呈現出3級對稱形式;在第II類複合物中,BA.1 Spike蛋白隻有一個RBD處于“半開放”構象,另兩個RBD均處于“開放”構象。在這兩類複合物中,1H1結合RBD的表位與ACE2結合位點均不重疊,表明1H1不直接與ACE2競争結合RBD。進一步的結構分析表明,1H1通過自身的空間位阻或誘導RBD穩定在“半開放”構象,從而阻斷Spike蛋白與受體ACE2結合,進而發揮中和作用。

圖2. 冷凍電鏡結構揭示1H1避開Omicron突變位點的獨特結合模式
為了進一步揭示1H1對Omicron具有廣譜中和活性的結構基礎,研究團隊使用局部分辨率優化技術将BA.1 RBD-1H1 Fab相互作用界面的分辨率提升至3.52 Å。研究人員發現,BA.1 RBD包含的15個突變位點都沒有分布在1H1的表位上。此外,除了在BA.1.1中發現的R346K突變位點外,其他Omicron亞系(包括BA.2、BA.3和BA.4/BA.5)中額外增加的突變位點也都避開了1H1的表位,表明Omicron變異不會直接影響1H1與RBD之間的相互作用。因此,研究團隊證明1H1具有強大的結合能力和不受Omicron突變影響的獨特表位區域,使其成為一種潛在的高效和廣譜單克隆抗體,可用于對抗不同的新型冠狀病毒變異毒株。
綜上所述,本研究鑒定了一種對BA.1, BA.1.1, BA.2, BA.2.12.1, BA.2.75, BA.3和BA.4/5具有廣譜中和效力的兔源單克隆抗體1H1,可以對抗不同的新型冠狀病毒變異毒株,包括Delta和Omicron,并闡明1H1廣譜中和活性的分子機制,為廣譜抗體設計和疫苗研發提供新的思路。該研究成果以“Mechanism of a rabbit monoclonal antibody broadly neutralizing SARS-CoV-2 variants”為題,于2023年4月3日發表在國際期刊《通訊-生物》(Communications Biology)上。伟徳国际官网登录入口博士後郭航天、伟徳国际官网登录入口碩士研究生楊繹煊、南京鼓樓醫院碩士研究生趙甜甜和上海科技大學免疫化學研究所博士研究生盧宇馳為該論文的共同第一作者,伟徳国际官网登录入口籍曉雲教授和伟徳国际官网登录入口醫學院附屬鼓樓醫院陳雨欣為該論文的共同通訊作者。該研究工作也得到了國家重點研發計劃和國家自然科學基金等項目的資助,在此一并緻謝!
關鍵詞:新型冠狀病毒;奧密克戎;兔源單克隆抗體;冷凍電鏡;廣譜中和抗體。
原文鍊接:https://www.nature.com/articles/s42003-023-04759-5