腫瘤免疫治療的最終目标是消除癌細胞,其中CD8+ 細胞毒性T細胞(CTL)是關鍵的免疫監視細胞之一。腫瘤組織中高豐度的具有殺傷功能的CTL是良好的預後指标,提高患者腫瘤組織中具有殺傷功能的CTL的比例有助于抑制腫瘤的進展甚至最終消除腫瘤。因此,準确地鑒定出一群具有殺傷功能的CTL亞群,将為臨床免疫治療提供新的策略和思路。
哈佛大學醫學院侯立飛博士2019年在多發性硬化症(MS)和小鼠實驗性腦脊髓炎(EAE)模型中鑒定出一群免疫功能過強的緻病性T細胞亞群高表達CXCR6 1。伟徳国际官网登录入口研究人員受到中國傳統陰陽平衡思想的啟發,以自身免疫病中高度活化的炎症性T細胞的表型特征,來推測腫瘤中該表型的T細胞是否仍然具有高度活化或者較強細胞毒活性的殺腫瘤能力?在這種設想下,研究人員探讨了腫瘤微環境中CXCR6的表達與腫瘤免疫治療之間的關系。
研究設想示意圖
研究人員首先綜合分析了北京大學張澤民教授發表的人和小鼠結腸癌單細胞測序數據,發現相較于外周組織和二級淋巴組織,CXCR6隻在腫瘤組織中高表達。接着利用免疫熒光實驗和流式細胞術驗證了該結果,CXCR6特異性高表達在腫瘤組織中的CD8+ T細胞上,而且鑒定出了CXCR6+CD8+ T細胞比CXCR6-CD8+ T細胞表達更高水平的活化分子(如CD69等)及效應因子(如IFN-γ、GZMB等)。這一現象在小鼠黑色素瘤模型上同樣得到驗證。為了确證CXCR6是否為CD8+ T細胞發揮抗腫瘤效應所必需,研究人員利用CD8敲除鼠和CXCR6敲除鼠構建了骨髓嵌合鼠模型,從而實現CD8+ T細胞上特異敲除CXCR6而其他細胞上正常表達CXCR6,結果顯示CD8+ T細胞上特異敲除CXCR6後,腫瘤的進程加快,生存期變短,腫瘤組織中浸潤的CD8+ T細胞的比例顯著減少,細胞毒性功能也顯著降低。給予anti-PD-1抗體治療後,敲除了CXCR6的小鼠基本不響應anti-PD-1治療。此外,研究人員還發現相較于結腸癌微衛星穩定型(MSS),微衛星高度不穩定型(MSI-H)的結腸癌組織中CXCR6表達更高。這一結果一定程度上也呼應了MSI-H為何更響應免疫檢查點療法。TCGA數據庫的分析結果也顯示,CXCR6表達越高,患者的預後越好。
過比較CXCR6和CXCL16在免疫治療前後的表達變化及外周血和腫瘤組織中CXCR6+CD8+ T細胞和CXCL16在腫瘤進程中的動态變化,發現CXCR6在腫瘤中的高度富集,配體CXCL16的趨化作用并不是最主要的誘因,而是在腫瘤組織中被誘導起來的。體外被腫瘤組織誘導起來的CXCR6+CD8+ T細胞不僅可以抑制小鼠腫瘤生長,還可以增強anti-PD-1的療效。
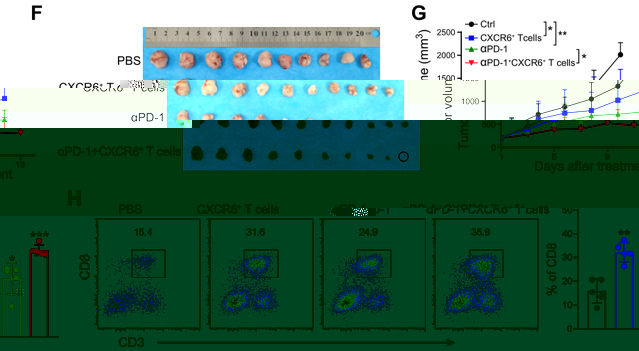
CXCR6+CD8+ T細胞可增強anti-PD-1的療效
值得一提的是,今年8月2日美國麻省總醫院免疫和炎症疾病中心Thorsten R Mempel課題組發表在Cell雜志上的一篇文章也指出,CXCR6可幫助細胞毒性T淋巴細胞在腫瘤微環境中定位并接收關鍵存活信号,CXCR6的表達可預測多種免疫原性實體癌患者的生存期2。
總而言之,該研究發現瘤内細胞毒性T淋巴細胞發揮抗腫瘤作用需要CXCR6的存在,這一發現将有助于聯合免疫療法的合理設計,CXCR6或可作為CART細胞過繼轉輸治療前的一個檢測指标,為臨床轉輸治療的有效性提供一種依據。
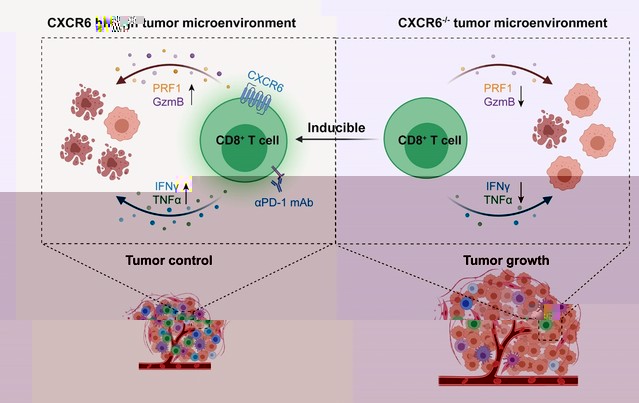
Working model
該成果以CXCR6 Is Required for Anti-tumor Efficacy of Intratumoral CD8+ T Cell為題于2021年8月30日在BMJ旗下腫瘤免疫治療學會(Society for Immunotherapy of Cancer)官方期刊Journal for ImmunoTherapy of Cancer(1區,IF: 13.751)在線發表(https://doi.org/10.1136/jitc-2021-003100)。

伟徳国际官网登录入口王冰琳博士和南京中醫藥大學王一博士是該論文的共同第一作者,伟徳国际官网登录入口孫洋教授、徐強教授和上海市第六人民醫院陳紅旗副主任醫師是該論文的共同通訊作者,中國科學技術大學伟徳国际官网登录入口田志剛院士、江蘇省人民醫院腫瘤科顧豔宏主任以及南京中醫藥大學第三附屬醫院肛腸科樊志敏主任對該研究亦有貢獻。美國Edelweiss公司為本研究提供了CXCR6單抗,哈佛大學醫學院侯立飛博士為該研究提供了很多建設性意見,在此表示感謝!該研究工作也得到了國家自然科學基金重點項目、重大研究計劃、面上項目和伟徳国际官网登录入口登峰計劃等項目的資助,在此一并緻謝!
參考文獻
1 Hou, L. et al. SerpinB1 controls encephalitogenic T helper cells in neuroinflammation. Proc Natl Acad Sci U S A116, 20635-20643, doi:10.1073/pnas.1905762116 (2019).
2 Di Pilato, M. et al. CXCR6 positions cytotoxic T cells to receive critical survival signals in the tumor microenvironment. Cell184, 4512-4530, e4522, doi:10.1016/j.cell.2021.07.015 (2021).