近日,伟徳国际官网登录入口朱海亮教授團隊與合作者們在轉鐵蛋白納米材料對中樞神經腫瘤治療方面取得新的進展。
腫瘤微環境(TME)具有與正常生理條件不同的物理化學特征,如缺氧、低 pH、高GSH和高血管通透性。其中缺氧環境與腫瘤生長、轉移與預後密切相關。腫瘤内部血管不受控制的增殖和異常發育決定了腫瘤高代謝的特點。腫瘤細胞的高代謝特性造成腫瘤細胞内部缺氧微環境,缺氧微環境對腫瘤細胞具有篩選作用,進一步提高腫瘤的惡性程度,導緻腫瘤細胞對化療藥物或放射治療不敏感。伟徳国际官网登录入口朱海亮教授團隊在先前聚焦解決TME缺氧問題的納米載藥平台開發基礎上(ACS Appl. Mater. Interfaces 2020, 12, 22, 24662–24674)根據轉鐵蛋白及其受體的同源識别能力,首次構建原位腦膠質瘤靶向轉鐵蛋白介導的内源刺激響應性多功能納米載藥平台(圖1)。該平台解決藥物穿過血腦屏障、靶向緩控釋藥、影像示蹤及腫瘤缺氧難題,顯著性抑制了包括中樞神經系統(CNS)腫瘤在内的多種惡性腫瘤的生長,緩解了實體瘤微環境中難治性的缺氧問題,實現了光動力治療聯合化療效果的協同性增強,為惡性腫瘤的治療提供了一種新策略。
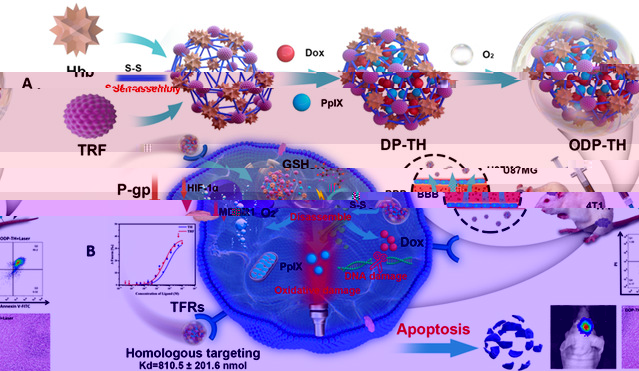
圖1.ODP-TH多功能藥物納米遞送平台的3D體外構建示意圖(A)和體内模塊化作用機制(B)
将轉鐵蛋白和血紅蛋白通過二硫鍵重構的自組裝方式包載化療藥物Dox和光敏劑PpIX,體外整合氧氣構建出既具有攜氧能力又具有原位腦膠質瘤精準靶向性功能的雜合蛋白納米載藥平台ODP-TH。一方面,該轉鐵蛋白藥物載體能特異性識别并結合腫瘤及腦内皮細胞細胞表面過表達的轉鐵蛋白受體,經轉鐵蛋白受體介導跨過血腦屏障,選擇性地富集到中樞神經腫瘤細胞處,在低氧高GSH濃度的腫瘤微環境中将包封的藥物和運載的氧氣快速、持續釋放。另一方面研究供氧型轉鐵蛋白介導的多功能納米載藥系統對了解腫瘤微環境缺氧的而導緻的疾病機制,建立成體系的生物安全性好、靶向性強、響應迅速及協同抗腫瘤的供氧型藥物納米遞送平台方法,解決由于缺氧引起的多種氧氣相關基因表達紊亂(MDR1、HIF-1α和P-gp),減少化療藥物外排,緩解化療中常見的耐藥不良現象有着深遠現實的應用價值。
較小的納米材料粒徑(30.2±1.2 nm)最大程度地助力了ODP-TH表面攜氧,使其能在低pO2的環境中30 min内完成氧合構象至脫氧構象的自由轉換。牢固的二硫鍵鉚釘,使ODP-TH在非TME中維持形态及功能的穩定。一旦進入還原型GSH富集的TME後,其優異的GSH響應機制能确保納米材料迅速發生崩解,确保整個平台的協同治療功能在特定癌竈區域内快速發揮作用(圖2)。
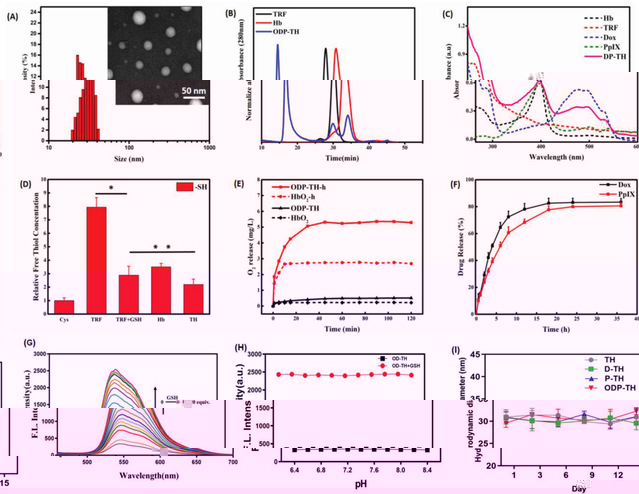
2.ODP-TH藥物納米遞送平台的理化性質。(A)ODP-TH的粒徑分布及透射電鏡照片。(B)TH納米外殼的排阻色譜(SEC)圖。(C)Hb、TRF、Dox、PpIX和DP-TH的紫外吸收光譜圖(UV–vis)。(D)不同組别間遊離巯基濃度的比較統計圖。(E)不同組别間氧氣釋放曲線統計圖。(F)ODP-TH在 GSH(5 mm)作用下不同時間的藥物釋放曲線。(G)Dox的釋放和GSH濃度的依賴關系。(H)pH值的變化對藥物釋放的影響。(I)TH、D-TH、P-TH 和ODP-TH 其水合粒徑與時間依賴圖。
團隊還構建了原位腦膠質瘤動物模型,利用液質聯用、腫瘤免疫、蛋白純化、細胞遷移檢測、多模态成像等技術統地評估了該納米平台跨血腦屏障靶向腦膠質瘤的功能及其藥物學特性。該平台通過基于氧氣靶向運輸實現多維度光動力治療聯合化療效果的協同性增強(圖3),不僅為未來徹底治愈腦膠質瘤提供新的方法,還為生命科學、醫學、化學與材料學等學科的相互交叉融合發展提供新的思路。
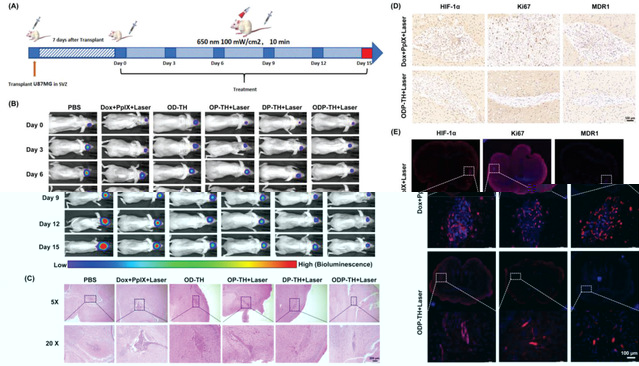
3.原位腦膠質瘤療效。(A)原位腦膠質瘤治療過程示意圖。(B)在治療過程中對腦膠質瘤發展的實時監測。(C)終點後不同治療組别小鼠腦切片HE染色圖片。(D,E)不同治療組别小鼠腦切片免疫組化及免疫熒光圖片。
該工作以Multifunctional Protein Hybrid Nanoplatform for Synergetic Photodynamic Chemotherapy of Malignant Carcinoma by Homologous Targeting Combined with Oxygen Transport為題發表在Advanced Science2022,2203742上。伟徳国际官网登录入口生科院18級博士研究生武松宇為本文的第一作者,伟徳国际官网登录入口生科院朱海亮教授、王忠長副研究員,南京醫科大學鄒美娟副教授和鄭州大學附屬兒童醫院段勇濤副研究員為本文的通訊作者,伟徳国际官网登录入口為第一作者和通訊單位。伟徳国际官网登录入口生科院19級碩士許朱民、康倩瑾對本研究工作做出重要貢獻。特别感謝伟徳国际官网登录入口江亞軍研究員對該工作的支持和幫助!該研究工作得到了國家自然科學基金、中國博士後科學基金等項目的資助。論文在線鍊接為:https://doi.org/10.1002/advs.202203742。